中国药典没有特殊的说明,贮藏条件应基于产品的稳定性考察,药典中的贮藏条件仅作参考,在其它药典中是有明确的说明,由于中国也执行ICH,应基于稳定性考察制定贮藏条件。
1、Ph. Eur. 1.5.1.10 Storage
The information and recommendations given in the Storage section do not constitute a pharmacopoeial requirement.
2、USP 659 Such directions apply except where the label on the article has different storage conditions that are based on stability studies.
3、EMA GUIDELINE ON DECLARATION OF STORAGE CONDITIONS: The storage conditions for medicinal products should be based on evaluation of the stability studies undertaken on the finished product.
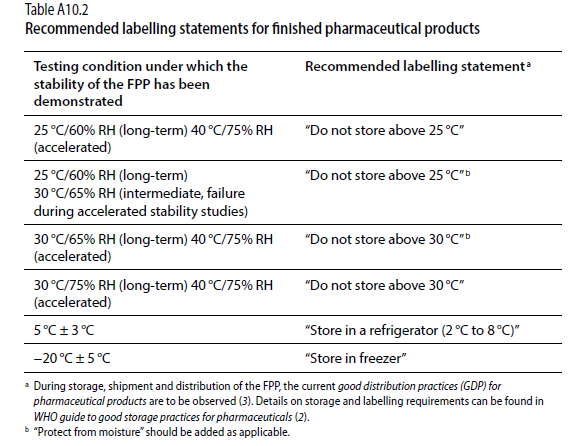
1、《中国药典》是最低要求;
2、《中国药典》2025年版关于贮藏项下的描述(与2020年版对比,删除了最后的“由于注射剂与眼用制剂等的包装容器均直接接触药品,可视为该制剂的组成部分,因而可写为“密闭保存”。)

注册标准为:“避光,密闭保存”,2025版标准为:“密封,在凉暗处保存”。2025版标准的贮藏要求更高,更严。
3、根据2025年版中国药典实施有关事项解读一的内容:2. 2025年版《中国药典》实施后,药品上市许可持有人应如何开展变更工作?答:根据《药品标准管理办法》第八条和第三十一条规定,药品上市许可持有人应当落实药品质量主体责任,及时关注国家药品标准制定和修订进展,对其生产药品执行的药品标准进行适用性评估,并开展相关研究工作。2025年版《中国药典》药典颁布后,执行药品注册标准的,药品上市许可持有人应当及时开展相关对比研究工作,评估药品注册标准是否符合2025年版《中国药典》标准有关要求。对于需要变更药品注册标准的,药品上市许可持有人应当按照药品上市后变更管理相关规定提出补充申请、备案或者报告,并按要求执行。经评估,涉及审批类变更的,应在2025年版《中国药典》实施之日前提出,审评审批期间仍可执行原标准;补充申请审批完成后,按批准的内容执行。
小结:具体变更事宜参见属地关于2025版药典的要求,个人角度理解会按照2025版药典执行。如果不想按照25版执行,建议可以去查一下当初的研究资料,是否易吸潮风化等,稳定性考察的温度以及多批留样数据,持续稳定性考察数据等进一步评估,确认,在于当地省局沟通。
这{{threadTextType}}正{{isAdminText}}
为帮助审核人员更快处理,请填写举报原因:
为帮助审核人员更快处理,请填写举报原因:
